-
丂
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂惔彮擺尵偺傛偆側榁彈偺晹壆
丂丂丂丂丂
丂丂丂儕僠僂儉嬻婥擇師揹抮丂(VER
006)
OCTOBER
10 2014
丂

乮嘪乯
丂 儕僠僂儉嬻婥擇師揹抮
[侾]丂丂丂奣擮丂丂丂
乮侾乯丂尰忬偱偼乽俤倁乿偺峲懕嫍棧傪乽侾侽侽侽倠倣乿埲忋偵偡傞曽朄偼乮嘩乯偱弎傋偨
丂丂丂
乽俙俴亅俥俠乿偐乽俵俧亅俥俠乿傪乽儗儞僕丒僄僋僗僥儞僟乿偲偟偰
丂丂丂
棙梡偡傞曽朄偑堦斣幚梡偵嬤偄丅
乮俀乯丂偟偐偟偙偺乽婎杮摿嫋乿偼乽僥僗儔幮乿偵埇傜傟偰偄傞丅
乮俁乯
乽儕僠僂儉嬥懏乿偼嵟傕乽廳検僄僱儖僊乕枾搙乿偺崅偄嬥懏偱偁傞丅
丂丂丂
偡側傢偪
乽儕僠僂儉嬥懏乿偺乽廳検僄僱儖僊乕枾搙乿偼乽侾侾侾係侽倂俫/倠倗乿偱偁傞偐傜丄
丂丂丂丂傎傏乽僈僜儕儞乿偺乽廳検僄僱儖僊乕枾搙乿偵旵揋偡傞丅
乮係乯
備偊偵乽儕僠僂儉乿傪乽晧嬌妶暔幙乿偵梡偄傞偲乽廳検僄僱儖僊乕枾搙乿偺崅偄乽擇師揹抮乿偑摼傜傟傞丅
丂丂
丂偦偺偆偪偱堦斣乽廳検僄僱儖僊乕枾搙乿丄乽懱愊僄僱儖僊乕枾搙乿偑
丂丂丂丂崅偄偺偑嵞廩揹偑壜擻側乽儕僠僂儉嬻婥擇師揹抮乿乮埲壓乽俼俴俙俛乿偲尵偆乯偱偁傞丅
乮俆乯丂乽俼俴俙俛乿偼乽晧嬌妶暔幙乿偵乽儕僠僂儉嬥懏乿丄乽惓嬌妶暔幙乿偵乽嬻婥乿偺乽巁慺乿傪巊偆
丂丂丂丂嵞廩揹壜擻側乽擇師揹抮乿偱偁傞丅
丂丂丂
乮俇乯
丂廬偭偰嬤偄彨棃乽俼俴俙俛乿偑幚梡壔偝傟傟偽丄乽廳検僄僱儖僊乕枾搙乿偑
丂丂丂丂乽侾侽侽侽倂俫/倠倗乿傪挻偊傞乽擇師揹抮乿偲側傝丄乽俼俴俙俛乿偐傜峔惉偝傟傞乽俀侽侽倠倂俫乿埲忋偺乽俛俹乿傪乽俤倁乿偵搵嵹偡傟偽
丂丂丂丂乽侾侽侽侽倠倣乿埲忋偺憱峴嫍棧傪幚尰偡傞偙偲偑弌棃傞丅
乮俈乯丂尰忬偺媄弍揑側壽戣偼乽僒僀僋儖摿惈乿偲乽揹棳枾搙乿傪幚梡揑側儗儀儖偵傑偱岦忋偡傞偙偲偱偁傞丅
乮俉乯丂尰忬偱偼乽揹夝幙乿偱暘椶偟偰戝偒偔巐偮偺曽幃偺尋媶偑側偝傟偰偄傞丅
[俀]丂丂丂曽幃乮侾乯丂丂丂丂乽揹夝幙乿偑乽旕悈揹夝塼乿偺乽俼俴俙俛乿
[俀丏侾]丂丂丂奣擮丂
乮侾乯丂乽惓嬌乿偲乽晧嬌乿偺娫偺乽揹夝幙乿偵乽旕悈揹夝塼乿傪梡偄偨乽俼俴俙俛乿乮埲壓乽俶俙乕俼俴俙俛乿偲尵偆乯偑
丂丂丂丂尋媶偺庡棳偱偁傞丅丂
乮俀乯丂偙偺僔僗僥儉偺戝偒側栤戣偼嬻婥拞偺乽悈暘乿傗乽扽巁僈僗乿傪彍嫀偟偰
丂丂丂
乽惓嬌乿傊偼乽巁慺乿偩偗傪娭梌偝偣側偗傟偽側傜側偄丅
乮俁乯丂乽悈暘乿傗乽扽巁僈僗乿偼乽俶俙乕俼俴俙俛乿偵埆塭嬁傪媦傏偡丅
乮係乯丂偦偺偨傔偵乽惓嬌乿偺乽嬻婥庢傝擖傟岥乿偵乽巁慺摟夁枌乿傪巊偆偐
丂丂丂
乽俶俙乗俼俴俙俛乿偺乽惓嬌乿傊乽巁慺乿偺嫮惂憲婥傪峴偆丅
乮俆乯丂乽俶俙乕俼俴俙俛乿偺乽晧嬌妶暔幙乿偺乽嬥懏儕僠僂儉乿偼
丂丂 丂乽曻揹夁掱乿偵偍偄偰乽揹巕乿傪乽摫懱乿偵曻弌偟偰乽儕僠僂儉丒僀僆儞乿傪乽揹夝幙乿偵梟弌偝偣傞丅
乮俇乯丂偦偟偰梟弌偟偨乽儕僠僂儉丒僀僆儞乿偼乽僀僆儞揹摫搙乿偺崅偄乽旕悈揹夝幙乿偺拞傪堏摦偟偰
丂丂丂丂乽惓嬌乿偵摓払偡傞丅
乮俈乯丂乽惓嬌乿偱嬻婥拞偺乽巁慺乿偼乽摫懱乿偐傜乽揹巕乿傪庴偗庢偭偰娨尦偝傟偰乽巁慺僀僆儞乿偵側傝丄
丂丂丂 乽惓嬌乿偵棃偨乽儕僠僂儉丒僀僆儞乿偲寢崌偟偰乽曻揹惗惉暔乿偺
丂丂丂
乽巁壔儕僠僂儉乿乮俴俀俷乯丄乽夁巁壔儕僠僂儉乿乮俴俀俷俀乯偑惗偠傞丅
乮俉乯丂乽巁壔儕僠僂儉乿偼晄埨掕偱庡偵乽夁巁壔儕僠僂儉乿偑乽惓嬌乿偵愅弌偡傞丅
乮俋乯丂乽廩揹夁掱乿偱偼乽夁巁壔儕僠僂儉乿偑暘夝偝傟偰乽揹巕乿偑乽摫懱乿偵曻弌偝傟偰乽儕僠僂儉丒僀僆儞乿偑
丂丂丂
乽揹夝幙乿偵曻弌偝傟丄乽巁慺乿偑奜晹偵曻弌偝傟傞丅
乮侾侽乯丂乽廩揹夁掱乿偱偼乽儕僠僂儉丒僀僆儞乿偼乽揹夝幙乿傪堏摦偟偰乽晧嬌乿偵払偟偰乽摫懱乿偐傜
丂丂丂丂乽揹巕乿傪庴偗庢偭偰乽儕僠僂儉嬥懏乿偲側偭偰乽晧嬌乿偺乽儕僠僂儉嬥懏乿偵愅弌偡傞丅
乮侾侾乯丂偙偺愅弌偵敽偭偰乽僨儞僪儔僀僩乿偺庽忬撍婲偑乽晧嬌乿偵尰弌偡傞丅
丂丂丂丂乽僨儞僪儔僀僩乿偺杊巭傕壽戣偱偁傞偑丄偦傟傎偳怺崗偵偼峫偊傜傟偰偄側偄丅丂
乮侾俀乯丂乽曻揹夁掱乿偵尷傟偽丄僾儘僙僗偼乽俹俤亅俥俠乿偺敪揹偺僾儘僙僗偲椶帡偟偰偄傞丅
丂丂丂丂
乽悈慺僀僆儞乿偑乽儕僠僂儉丒僀僆儞乿偵側偭偰偍傝丄乽屌懱崅暘巕枌乿偑乽揹夝幙乿偵側偭偰偍傝
丂丂丂
丂乽曻揹惗惉暔乿偺乽悈乿偑乽夁巁壔儕僠僂儉乿偵側偭偰偄傞丅
[俀丏俀]丂丂媄弍揑壽戣
[俀丏俀丏侾]丂丂乽旕悈揹夝塼乿偺嵟揔壔
乮侾乯丂
埲慜偼乽俶俙乕俼俴俙俛乿偵偍偄偰傕乽儕僠僂儉丒僀僆儞揹抮乿偺傛偆側乽僇乕儃僱乕僩宯乿偺乽桳婡揹夝塼乿偑
丂丂丂丂乽揹夝幙乿偵梡偄傜傟偰偄偨丅
乮俀乯丂
偟偐偟乽僇乕儃僱乕僩宯乿偺乽桳婡揹夝塼乿偱偼乽惓嬌乿偱乽夁巁壔儕僠僂儉乿偺惗惉偑
丂丂丂丂慾奞偝傟傞偙偲偑暘偐偭偰偙偺崰偱偼巊傢傟側偔側偭偨
乮俁乯丂
偦偙偱怴偨偵乽惓嬌乿偱偺乽巁慺乿偺乽娨尦斀墳乿傪埨掕偵峴傢偣偰崅偄乽揹棳枾搙乿偑摼傜傟傞乽旕悈揹夝塼乿
丂丂丂丂偺尋媶偑峴傢傟偰偄傞丅丂
[俀丏俀丏俀]丂丂丂惓嬌偺峔憿
乮侾乯丂乽惓嬌乿偵庡偵乽斀墳柺愊乿偑戝偒偄乽僇乕儃儞丒僽儔僢僋乿偑梡偄傜傟傞丅
乮俀乯丂摿偵乽巁慺乿偺乽娨尦斀墳乿傪懀恑偝偣傞乽怗攠乿偺慖掕偑廳梫偱偁傞丅
乽俀丏俀丏俁乿丂丂丂晧嬌偺峔憿
乮侾乯丂丂廩揹帪偺乽儕僠僂儉嬥懏乿傊偺乽儕僠僂儉乿偺愅弌偵傛偭偰惗偠傞乽僨儞僪儔僀僩乿偺杊巭丅
[俀丏俁]丂丂丂乽俶俙乕俼俴俙俛乿偺尋媶偺惉壥偺椺
乮侾乯丂 乽旕悈揹夝塼乿偵乽俢俵俽俷(Dimethyl
Sulfoxide)乿偑巊梡偝傟偰乽俶俙乕俼俴俙俛乿偺乽惓嬌乿偱偺乽揹棳枾搙乿偲
丂丂丂丂乽僒僀僋儖惈擻乿偼寑揑側恑曕傪尒偣巒傔偰偄傞丅
乮係乯丂乽惓嬌乿偺乽嵽椏乿丄乽峔憿乿偲乽怗攠乿偺岺晇偵傛偭偰乽俶俙乕俼俴俙俛乿偺乽揹棳枾搙乿偲乽僒僀僋儖摿惈乿偼
丂丂丂
幚梡揑側抣偵嬤晅偄偰偄傞傛偆偵尒偊傞丅丂
乮俆乯丂偄傛偄傛乽俤倁乿偵搵嵹偡傞偨傔偺乽俶俙乕俼俴俙俛乿偺僗僞僢僋峔憿偺尋媶偵擖偭偰偄偔丅
[俀丏俁丏侾]丂丂Bing
Sun, Paul Munroe & Guoxiu Wang丂偺尋媶惉壥
丂丂丂丂丂
丂丂丂丂丂[Scientific
Reports 3, Article number: 2247] doi:10.1038/srep02247
丂丂丂丂丂丂丂丂丂丂(Received 14
May 2013 Accepted 03 July 2013 Published 22 July
2013)
[俀丏俁丏侾丏侾]丂丂丂丂僔僗僥儉偺峔惉
乮侾乯丂偙偺尋媶帠椺偱偼乽揹夝塼乿偵乽俢俵俽俷乿乮Dimetyl丂Sulfoxide; (CH3)2SO
)傪梡偄偰偄傞丅
乮俀乯丂乽惓嬌乿偵乽儖僥僯僂儉怗攠乿傪扴帩偟偨乽僇乕儃儞丒僽儔僢僋乿傪梡偄偰偄傞丅
[俀丏俁丏侾丏俀]丂丂丂丂尋媶寢壥
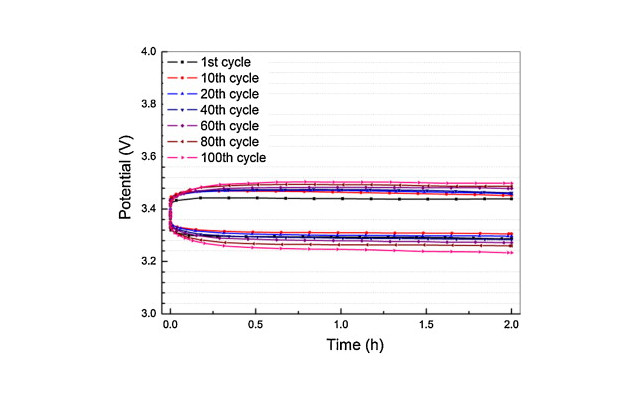
乮侾乯丂恾俙偺傛偆側僨乕僞偑摼傜傟偰偄傞丅
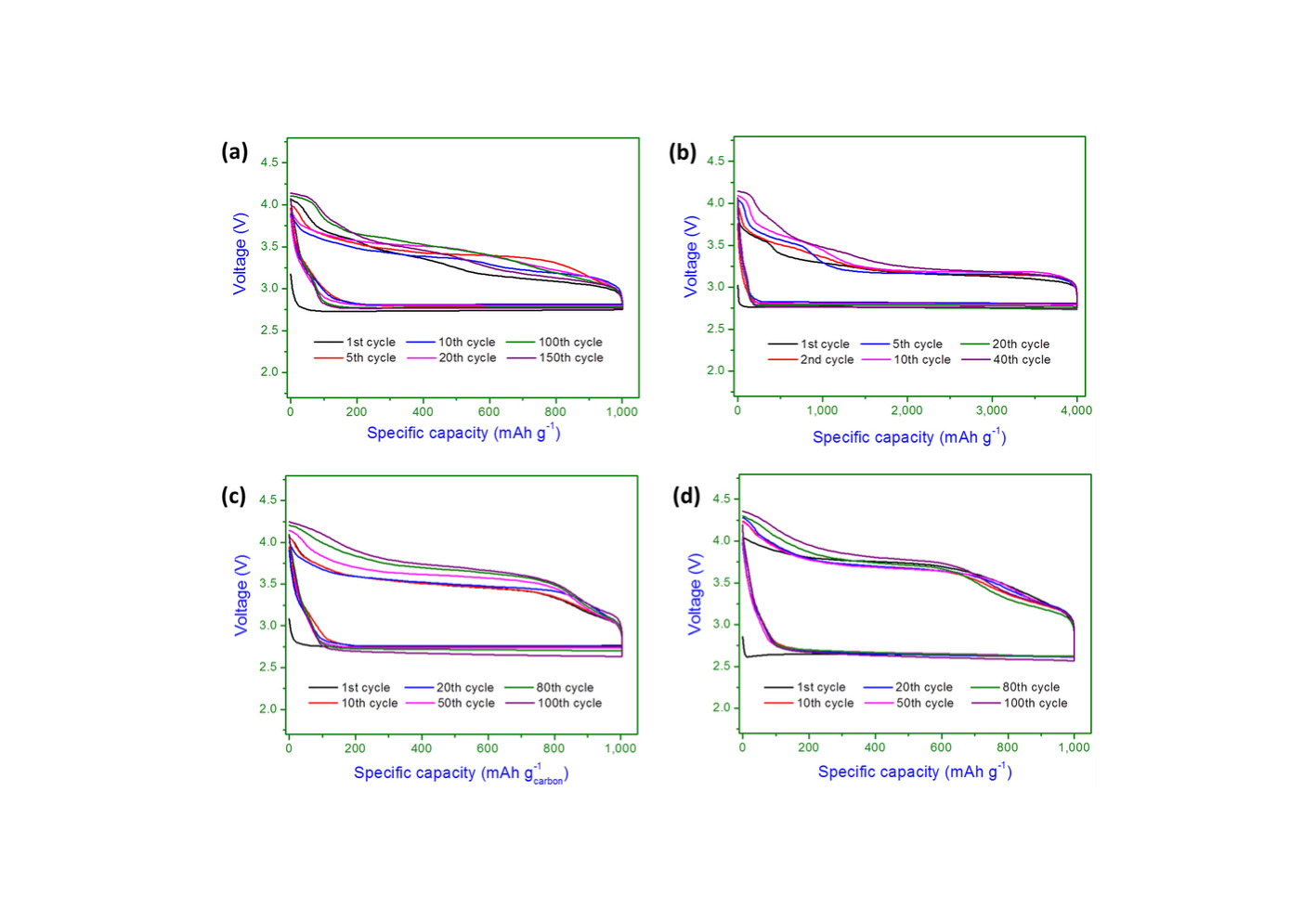
恾俙 Cycling performance of the Li-O2 cells with Ru-CB
catalyst at
different capacity limits and current densities.
(a,b) Voltage profiles
of
(a) (150 cycles) at (200 mA/ g) with curtailing the capacity to (1,000mAh/g) and
(b) (40 cycles) at (200 mA/ g) with curtailing the capacity to (4,000 mAh/g).
(c,d) Voltage profiles of (100 cycles) at
(c) (400 mA/ g)
and
(d)
(1,000 mA/ g) with curtailing the capacity to( 1,000 mAh/ g).
(THIS FIGURE IS QUOTED FROM THE FIG.5 OF THE PAPER SAID
ABOVE.)
乮侾乯丂乽揹棳枾搙乿偑乽俰亖俀侽侽倣俙/倗乿偱乽侾俆侽僒僀僋儖乿傑偱幚峴偟偨寢壥偑帵偝傟偰偄傞丅
丂丂 丂偙偺偲偒偺乽梕検乿偼廔斦偱乽俀丏俈俆倁乿丄乽俻亖侾侽侽侽倣俙俫/g乿偑摼傜傟偰偄傞丅
乮俀乯丂乽揹棳枾搙乿偑乽俰亖俀侽侽倣俙/倗乿偱乽係侽僒僀僋儖乿傑偱幚峴偟偨寢壥偑帵偝傟偰偄傞丅
丂丂丂偙偺偲偒偺乽梕検乿偼廔斦乽俀丏俈俆倁乿丄乽係侽侽侽倣俙俫/倗乿偑摼傜傟偰偄傞丅
乮俁乯丂乽揹棳枾搙乿偑乽俰亖係侽侽倣俙/倗乿偱乽侾侽侽僒僀僋儖乿傑偱幚峴偟偨寢壥偑帵偝傟偰偄傞丅
丂丂
丂偙偺偲偒偺乽梕検乿偼廔斦乽俀丏俈俆倁乿丄乽俻亖侾侽侽侽倣俙倛/倗乿偑摼傜傟偰偄傞丅
乮係乯丂乽揹棳枾搙乿偑乽俰亖侾侽侽侽倣俙/倗乿偱乽侾侽侽僒僀僋儖乿傑偱幚峴偟偨寢壥偑帵偝傟偰偄傞丅
丂丂
丂偙偺偲偒偺乽梕検乿偼廔斦乽俀丏俈俆倁乿丄乽俻亖侾侽侽侽倣俙倛/倗乿偑摼傜傟偰偄傞丅
[俀丏俁丏侾丏俁]丂丂丂寢壥偺昡壙
乮侾乯丂傛偔暘偐傜側偄偑丄乽惓嬌乿偱偺乽廳検乿摉偨傝偺乽揹棳枾搙乿偑乽俰亖侾侽侽侽倣俙/倗乿偱
丂丂丂 乽侾侽侽僒僀僋儖乿屻傕乽梕検乿偑乽俻亖侾侽侽侽倣俙倛乿偑堐帩偝傟偰偄偨偲偄偆偙偲偼
丂丂丂
幚梡揑側儗儀儖偵嬤偄偺偱偼側偄偐偲巚傢傟傞丅
乮俀乯丂偮傑傝帪娫偼乽俿亖俻/俰亖侾侽侽侽乮倣俙倛/倗乯/侾侽侽侽乮倣俙/倗乯亖侾倛乿偱偁傞丅
乮俁乯丂偙傟偼乽揹棳儗乕僩乿偑乽侾俠乿偱曻揹偟偰偄傞偙偲偵側傞丅
乮係乯丂傑偩乽侾侽侽僒僀僋儖乿偱偼晄懌偱偁傠偆偑丄
乽俢俵俽俷乿偺乽揹夝塼乿偺岠壥偼戝偒偄偲巚偆丅
[俀丏俁丏俀]丂丂丂H.G Jung et
al 偺尋媶惉壥
丂丂丂丂丂
丂丂
[Nat Chem 4 (2012)
p579]
[俀丏俁丏俀丏侾]丂丂丂僔僗僥儉偺峔惉
乮侾乯丂偙偺尋媶帠椺偱偼乽揹夝塼乿偵乽俿俤俧俢俵俤乿乮tetraethylene glycol
dimethyl ether ;
CH3O(CH2CH2O)4CH3)
傪梡偄偰偄傞丅
丂丂丂
乽巟帩墫乿偵偼乽俴倝俠俥俁俽俷俁乿傪梡偄偰偄傞丅
乮俀乯丂乽惓嬌乿偼乽俠倎倰倐倧値丂倧値丂俠倎倰倐倧値丂俹倎倫倕倰乿傪嵦梡偟偰偄傞丅
[俀丏俁丏俀丏俀]丂丂丂尋媶寢壥
乮侾乯丂丂恾侾偺傛偆側寢壥偑摼傜傟偰偄傞丅
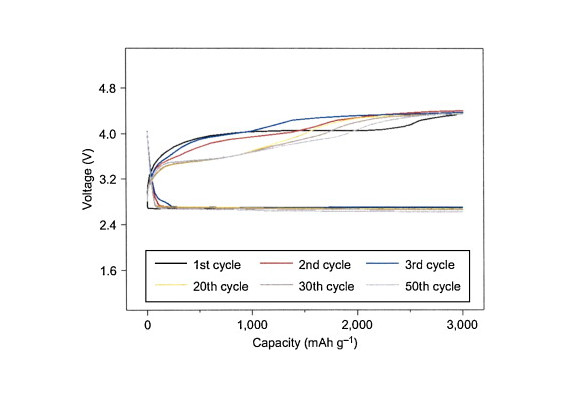
恾侾丂丂丂Cycling response of
the Li/TEGDME - LiCF3SO3/O2 Battery 丂 Rate= 500mA/g
(THIS FIGURE IS QUOTED FROM FIG.3 OF THE
PAPER SAID ABOVE.)
乮俀乯丂乽揹棳枾搙乿偑乽俰亖俆侽侽倣俙/倗亅俠乿偱梕検乽俻亖俁侽侽侽倣俙倛/倗亅俠乿偑摼傜傟偰偄傞丅
乮俁乯丂乽梕検乿偼乽俆侽僒僀僋儖乿屻傕乽俻亖俁侽侽侽倣俙倛/倗亅俠乿傪堐帩偟偰偄傞丅
乮係乯丂廩揹偲曻揹偺偱揹埑偺嵎偼丂俠俢儮亖侾丏俈倁丂掱搙偱偁傞丅
[俀丏俁丏俀丏俁]丂丂丂寢壥偺昡壙
乮侾乯丂偙偺椺偱偼揹棳枾搙乽俰亖俆侽侽倣俙/倗亅俠乿偼傑偩幚梡儗儀儖偵墦偄偲巚傢傟傞丅
乮俀乯丂偮傑傝帪娫偼乽俿亖俻/俰亖俁侽侽侽乮倣俙倛/倗乯/俆侽侽乮倣俙/倗乯亖俇倛乿偱偁傞丅
乮俁乯丂偮傑傝曻揹偺乽揹棳儗乕僩乿偼乽侽丏侾俈俠乿偱偺曻揹偱偁傞丅
乮係乯丂乽俆侽僒僀僋儖乿偼傑偩晄廫暘偱偁傞丅
[俀丏俁丏俁]丂丂丂乽搶杒戝妛乿偺尋媶惉壥
[俀丏俁丏俁丏侾]丂丂丂僔僗僥儉
乮侾乯乽壢妛媄弍怳嫽婡峔乿乮俰俽俿乯偲乽搶杒戝妛乿偺乽尨巕暘巕嵽椏壢妛崅摍尋媶婡峔乮俙俬俵俼乯乿偼
丂丂丂俀侽侾俆擭俋寧俀擔丄師悽戙偺擇師揹抮偲偟偰婜懸偝傟偰偄傞乽儕僠僂儉嬻婥揹抮乿偵偮偄偰丄
丂丂丂乽俁師尦峔憿乿傪帩偮乽僫僲懡岴幙僌儔僼僃儞乿傪乽惓嬌嵽椏乿偵梡偄傞偙偲偵傛傝丄崅偄乽僄僱儖僊棙梡岠棪乿偲
丂丂丂乽侾侽侽夞乿埲忋偺乽廩曻揹孞傝曉偟惈擻乿傪幚尰偟偨偲敪昞偟偨丅
乮俀乯丂乽俤倁乿偵梡偄傜傟偰偄傞乽儕僠僂儉僀僆儞揹抮乿偵懼偊偰偙偺乽儕僠僂儉嬻婥揹抮乿傪巊偊偽丄
丂丂丂丂乽俤倁乿偺枮廩揹偐傜偺乽憱峴嫍棧乿傪尰嵼偺乽俀侽侽倠倣乿掱搙偐傜乽俆侽侽乣俇侽侽倠倣乿偵怢偽偣傞偲偄偆丅
乮俁乯丂乽儕僠僂儉嬻婥揹抮乿偼丄乽惓嬌乿偱嬻婥拞偺乽巁慺乿丄乽晧嬌乿偱乽嬥懏儕僠僂儉乿傪梡偄傞擇師揹抮偱偁傞丅
乮係乯丂乽惓嬌乿偱乽儕僠僂儉乿偲乽巁慺乿偑斀墳偟乽夁巁壔儕僠僂儉乿乮俴倝俀俷俀乯傪惗惉偡傞偲曻揹偟丄
丂丂丂乽夁巁壔儕僠僂儉乿傪乽儕僠僂儉乿偲乽巁慺乿偵暘夝偡傞偙偲偱廩揹偡傞丅
乮俆乯丂乽儕僠僂儉嬻婥揹抮乿偼尰峴偺乽儕僠僂儉丒僀僆儞揹抮乿偲斾傋偰俆乣俉攞偺乽僄僱儖僊乕梕検乿傪幚尰偱偒傞
丂丂丂師悽戙偺乽擇師揹抮乿偲偟偰奐敪偑偡偡傔傜傟偰偄傞丅
乮俇乯丂偨偩偟尰帪揰偱偼丄廩揹偟偨揹椡傪曻揹偟偰棙梡偱偒傞斾棪傪帵偡乽僄僱儖僊乕棙梡岠棪乿傗丄
丂丂丂丂廩曻揹傪壗搙傕峴偊傞乽廩曻揹孞傝曉偟惈擻乿傪偼偠傔幚梡壔偵岦偗偨壽戣偼懡偄丅
乮俈乯丂乽儕僠僂儉嬻婥揹抮乿偼丄乽嬥懏儕僠僂儉乿偲乽嬻婥乿傪乽揹嬌乿偲偟偰屌懱丄塼懱丄婥懱偺乽嶰憡奅柺乿忋偱
丂丂丂丂乽揹巕乿偺傗傝偲傝偑峴傢傟傞丅
乮俉乯丂
偙偺偨傔丄乽惓嬌乮嬻婥嬌乯乿偼丄塼懱偲婥懱傪岠棪傛偔崿偤傞偙偲偑偱偒丄偐偮丄
丂丂丂丂怗攠忋偱岠棪傛偔乽儕僠僂儉僀僆儞乿偺乽巁壔乮曻揹乯乿偲乽夁巁壔儕僠僂儉偺暘夝乮廩揹乯乿傪
丂丂丂丂婲偙偣傞乽揹婥揱摫惈懡岴幙懱乿偑梡偄傜傟偰偄傞丅
乮俋乯丂崱夞偺乽儕僠僂儉嬻婥揹抮乿傪奐敪偟偨乽俙俬俵俼乿偺嫵庼偺乽捖柧執乿巵偺尋媶僌儖乕僾偼丄
丂丂丂
乽惓嬌乿偵梡偄傞乽揹婥揱摫惈懡岴幙懱乿偲偟偰丄乽巁壔儖僥僯僂儉乮RuO2乯僫僲棻巕怗攠乿傪乽僌儔僼僃儞乿偱嫴傫偩
丂丂丂丂乽拏慺僪乕僾僫僲懡岴幙僌儔僼僃儞乿傪嵦梡偟偨丅
乮侾侽乯丂偙偺乽僫僲懡岴幙僌儔僼僃儞揹嬌乿偵偼丄侾侽侽乣俁侽侽値倣偺戝偒偝偺
丂丂丂丂旝嵶岴傪帩偪丄偙偺僫僲僒僀僘偺旝嵶岴傪夘偟偰乽儕僠僂儉僀僆儞乿傗巁慺丄
丂丂丂丂揹夝幙傪墌妸偵桝憲偡傞丅
乮侾侾乯丂傑偨戝偒側乽嬻寗乿偺拞偵乽曻揹斀墳乿偺惗惉暔偱偁傞乽夁巁壔儕僠僂儉乿傪挋憼偱偒傞丅
乮侾俀乯丂偝傜偵偦偺戝偒側乽昞柺愊乿偺岠壥偵傛傝丄廩揹帪偵偍偗傞乽夁巁壔儕僠僂儉乿偺乽暘夝斀墳乿傪
丂丂丂丂丂懀恑偡傞婡擻傕桳偟偰偄傞丅
乮侾俁乯丂幚嵺偵乽憱嵏宆揹巕尠旝嬀乿乮俽俤俵乯傪梡偄偰丄乽僫僲懡岴幙僌儔僼僃儞揹嬌乿偺
丂丂丂丂廩揹慜偲廩揹屻偺忬懺傪妋擣偟偨偲偙傠丄廩揹慜偵懚嵼偟偰偄偨乽夁巁壔儕僠僂儉乿偑廩揹屻偵
丂丂丂丂徚幐偡傞偲偲傕偵丄乽曻揹乿偵傛偭偰尦偺忬懺偵栠傞偙偲偑柧傜偐偵側偭偨丅
乮侾係乯丂偝傜偵丄乽摟夁宆揹巕尠旝嬀乿乮俿俤俵乯傪梡偄偰丄巊梡慜偲廩曻揹傪乽俆侽僒僀僋儖乿峴偭偨屻偺
丂丂丂丂乽巁壔儖僥僯僂儉僫僲棻巕怗攠乿偺忬懺傪尨巕儗儀儖偱娤嶡偟偨寢壥丄
丂丂丂丂怗攠偱偁傞乽巁壔儖僥僯僂儉僫僲棻巕乿偺僒僀僘偼曄傢偭偰偍傜偢丄廩曻揹偱
丂丂丂丂怗攠偵戝偒側曄壔傗楎壔偑婲偙傜側偄偙偲傪妋擣偱偒偨偲偄偆丅
[俀丏俁丏俁丏俀]丂丂丂幚尡寢壥
乮侾乯丂揹嬌偺恾傪恾侾偵帵偡丅

恾侾丂丂俁師尦峔憿傪帩偮僫僲懡岴幙僌儔僼僃儞傪惓嬌嵽椏偵梡偄偨僐僀儞宆偺儕僠僂儉嬻婥揹抮
丂丂丂丂丂丂丂乮this is quoted from JST
& AIMR)
(俀)丂丂丂丂恾俀偵帵偡丅
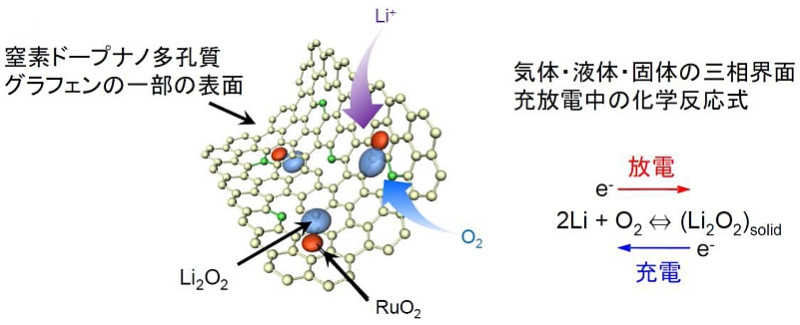
丂丂丂恾俀丂丂丂惓嬌偺僫僲懡岴幙僌儔僼僃儞忋偱峴傢傟偰偄傞偲偝傟傞壔妛斀墳丅
丂丂丂丂丂丂丂丂丂丂丂乮this is quoted from JST
& AIMR)
乮俁乯丂乽僫僲懡岴幙嬥懏乿傪恾俁偵帵偡丅

丂丂丂丂丂恾俁丂乽僫僲懡岴幙僌儔僼僃儞乿偺慜嬱懱偲側傞乽僫僲懡岴幙嬥懏乿偺俁師尦棫懱恾丅
丂乮this is quoted from JST &
AIMR)
乮係乯丂乽俽俤俵乿偺寢壥傪恾係偵帵偡丅

丂丂丂丂丂恾係丂巁壔儖僥僯僂儉僫僲棻巕怗攠傪嫴傫偩僫僲懡岴幙僌儔僼僃儞揹嬌偺俽俤俵夋憸偲俿俤俵夋憸丅
丂丂丂丂丂丂丂丂乮a乯俆侽僒僀僋儖廩揹慜偺俽俤俵夋憸丅墌斦忬偺乽夁巁壔儕僠僂儉乿偑惗惉偟偰偄傞偙偲偑妋擣偱偒偨丅
丂丂丂丂丂丂丂丂乮b乯俆侽僒僀僋儖廩揹屻偺俽俤俵夋憸丅
丂丂丂丂丂丂丂丂乮c乯廩揹帋尡屻偺僫僲懡岴幙僌儔僼僃儞揹嬌偺俿俤俵夋憸丅
丂丂丂丂丂丂丂丂丂丂丂侾侽侽乣俁侽侽値倣偺岴僒僀僘傪帩偮丅
丂丂丂丂丂丂丂丂丂丂丂俀乣俁憌偺乽僌儔僼僃儞乿偵暍傢傟偨俆値倣偺乽巁壔儖僥僯僂儉僫僲棻巕乿偑夡傟偢偵懚嵼偟偰偄傞偙偲偑
丂丂丂丂丂丂丂丂丂丂丂妋擣偱偒偨丅
丂丂丂丂丂丂丂丂乮this is quoted from JST & AIMR)
丂丂
乮俆乯丂丂廩曻揹僒僀僋儖摿惈傪恾俆偵帵偡丅
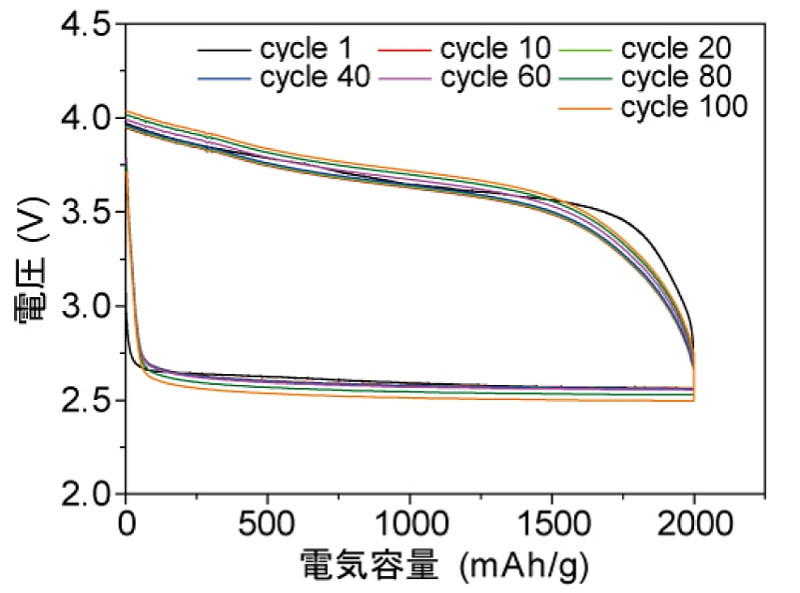
丂丂丂丂恾俆丂丂奐敪偟偨乽儕僠僂儉嬻婥揹抮乿偺廩曻揹摿惈偺帋尡寢壥丅
丂丂丂丂丂丂丂丂乮廩曻揹偺乽侾僒僀僋儖乿栚偐傜乽侾侽侽僒僀僋儖乿栚傑偱戝偒側曄壔偼婲偒偰偄側偄乯
丂
丂丂丂丂丂丂丂丂乮This
figure
is quoted from JST & AIMR)
[俀丏俁丏俁丏俁]丂丂丂昡壙
乮侾乯丂丂
崱夞奐敪偝傟偨乽儕僠僂儉嬻婥揹抮乿偼丄乽揹嬌扨埵廳検乿摉偨傝偺乽揹婥梕検乿偑
丂丂丂丂丂乽俀侽侽侽倣俙倛/倗乿丄乽廩曻揹孞傝曉偟惈擻乿偑乽侾侽侽僒僀僋儖乿埲忋偲
丂丂丂丂丂偙傟傑偱偺尋媶惉壥偲摨摍偱偁傝丄偦偺忋偱乽僄僱儖僊乕棙梡岠棪乿傕
丂丂丂丂丂乽俈俀亾乿埲忋偲斾尐偟摼傞惈擻偵側偭偰偄傞丅
乮俀乯丂
乽巁壔儖僥僯僂儉僫僲棻巕乿傪乽僌儔僼僃儞乿偱嫴傫偩
丂丂丂丂丂乽拏慺僪乕僾僫僲懡岴幙僌儔僼僃儞乿偼丄曻揹偟愗偭偨応崌偱
丂丂丂丂丂乽揹嬌扨埵廳検乿摉偨傝嵟戝乽俉俁侽侽倣俙倛乿偺揹婥梕検傪帩偮丅
乮俁乯丂丂偙傟傪丄乽揹嬌扨埵廳検乿摉偨傝乽俀侽侽侽倣俙倛/倗乿偺乽揹婥梕検乿偵屌掕偟偨応崌丄
丂丂丂丂丂乽侾侽侽僒僀僋儖乿埲忋偺乽廩曻揹乿偑偱偒傞偙偲偑暘偐偭偨丅
乮係乯丂丂偙偺偲偒偺乽僄僱儖僊棙梡岠棪乿偼乽俈俀亾乿傪挻偊偨偲偄偆丅
乮俆乯丂丂廩曻揹帪偺乽揹棳枾搙乿傪曄壔偝偣傞幚尡傪峴偭偨偲偙傠丄
丂丂丂丂
廬棃偺乽儕僠僂儉嬻婥揹抮乿傛傝傕廩揹僗僺乕僪偑懍偄偙偲傕敾柧偟偨偲尵偭偰偄傞偑
丂丂丂丂乽揹棳枾搙乿偺嬶懱揑側悢抣偑側偄丅
乮俇乯丂 丂崅壙側乽儖僥僯僂儉乿傪梡偄傞偙偲偵傛傞僐僗僩偺憹戝偼壽戣偺堦偮偲側傞丅
乮俈乯丂丂
傑偨丄乽惓嬌乿偱偺斀墳帪偵應掕偝傟傞揹埑偑棟榑抣傛傝傕崅偔側傝丄
丂丂丂丂丂惓嬌偺乽僌儔僼僃儞乿傗乽巁壔儖僥僯僂儉怗攠乿傪晠怘偡傞尨場偵側傞乽夁揹埑乿傪
丂丂丂丂丂彫偝偔偡傞偨傔丄乽揹嬌扨埵廳検乿摉偨傝偺乽揹婥梕検乿傪乽俀侽侽侽倣俙倛乿偵梷偊偰偄傞偑丄
丂丂丂丂丂乽揹婥梕検乿傪偝傜偵崅傔傞偵偼乽夁揹埑乿偦偺傕偺偺掅尭傕昁梫偵側傞丅
[俁]丂丂丂曽幃乮俀乯丂丂乽惓嬌乿偲乽晧嬌乿偺娫偺乽揹夝幙乿傪乽悈惈揹夝塼乿偵偡傞乽俼俴俙俛乿
[俁丏侾]丂丂奣擮
乮侾乯丂乽俶俙乕俼俴俙俛乿偱偼乽惓嬌乿傊乽曻揹惗惉暔乿偲偟偰旕摫揹惈偺屌懱偺乽夁巁壔儕僠僂儉乿偑愅弌偟偰
丂丂丂
乽惓嬌乿偺乽僇乕儃儞丒僽儔僢僋乿側偳傪乽揹嬌乿傪旐暍偟偰乽曻揹斀墳乿傪慾奞偡傞丅
乮俀乯丂偦偙偱乽惓嬌乿偲乽晧嬌乿偺娫偺乽揹夝幙乿傪乽悈惈揹夝塼乿偵偟偰
乽曻揹惗惉暔乿傪乽悈惈揹夝塼乿偵梟夝偡傞
丂丂丂丂乽悈巁壔儕僠僂儉乿偵偟偰
乽惓嬌乿傊偺愅弌傪杊巭偡傞偙偲偑弌棃傞丅丂
乮俁乯丂乽惓嬌乿偲乽晧嬌乿偺娫偺乽揹夝幙乿傪乽悈惈揹夝塼乿偵偡傞偙偲偱丄乮俀乯偺晄搒崌傪夞旔偡傞堦曽
丂丂丂
悈偲偼寖偟偔斀墳偡傞乽晧嬌乿偺乽儕僠僂儉乿傪 乽曐岇枌乿偱暍偆乽俼俴俙俛乿
丂丂丂
乮埲壓乽俙乕俼俴俙俛乿偲偄偆乯偵偮偄偰傕尋媶偝傟偰偄傞丅
乮俀乯丂偙偺応崌傕乽惓嬌乿傊偺乽扽巁僈僗乿偺怤擖偑慾巭偡傞昁梫偑偁傞丅
乮俁乯丂乽曻揹夁掱乿偱偼乽惓嬌乿偱偼乽巁慺乿偼乽揹巕乿傪乽摫懱乿偐傜庴偗庢偭偰乽悈乿偲斀墳偟偰
丂丂丂丂丂丂丂丂俀俫俀俷亄俷俀亄係倕乕丂丂丂佀丂丂係俷俫亅
丂丂丂丂偺傛偆側乽悈巁壔僀僆儞乿傪惗惉偡傞丅
乮俁乯丂偦偟偰乽悈惈揹夝塼乿偺拞偱乽晧嬌乿偐傜棃偨乽儕僠僂儉丒僀僆儞乿偲崌懱偟偰
丂丂丂丂乽曻揹惗惉暔乿偺乽悈巁壔儕僠僂儉乿偑惗惉偝傟傞丅
乮係乯丂乽曻揹惗惉暔乿偺乽悈巁壔儕僠僂儉乿偼乽悈惈揹夝塼乿偵梟夝偟偰偄傞丅
乮俆乯丂
偟偐偟乽曻揹夁掱乿偺恑峴偵敽偭偰乽悈惈揹夝塼乿拞偺乽悈巁壔儕僠僂儉乿偺検偑憹戝偡傟偽
丂丂丂丂朞榓梟塼忬懺偵側偭偰傗偑偰乽悈巁壔儕僠僂儉乿偑乽悈惈揹夝塼乿偵愅弌偡傞丅
乮俇乯丂愅弌偟偨乽悈巁壔儕僠僂儉乿偑乽惓嬌乿偵晅拝偟偰偼晄搒崌偱偁傞丅
乮俈乯丂乽惓嬌乿傪嬻婥拞偺乽扽巁僈僗乿傪幷抐偟偰乽悈宯揹夝塼乿偲乽悈巁壔僀僆儞乿偩偗傪
丂丂丂
捠偡乽傾僯僆儞揱摫懱乿偱旐偆曽朄傕採埬偝傟偰偄傞丅
乮俉乯丂乽廩揹夁掱乿偱偼乽悈宯揹夝塼乿偵梟夝偟偰偄傞乽悈巁壔儕僠僂儉乿傪
丂丂丂 暘夝偟偰乽揹巕乿傪乽惓嬌懁乿偺乽摫懱乿偵曻弌偟偰
乽儕僠僂儉丒僀僆儞乿偲乽巁慺乿傪曻弌偡傞丅
乮俋乯丂
乽儕僠僂儉丒僀僆儞乿偼乽曐岇枌乿傪摟夁偟偰乽晧嬌乿偺乽儕僠僂儉嬥懏乿偵棃偰
丂丂丂丂乽摫懱乿偐傜乽揹巕乿傪庴偗庢偭偰乽儕僠僂儉嬥懏乿偲側偭偰昞柺偵愅弌偡傞丅丂
[俁丏俀]丂丂乽俙乕俼俴俙俛乿偺媄弍揑壽戣丂
[俁丏俀丏侾]丂丂丂晧嬌偺峔憿
乮侾乯丂乽儕僠僂儉嬥懏乿傪乽曐岇枌乿偱旐暍偟偰乽悈惈揹夝塼乿偲斀墳偟側偄傛偆偵偡傞丅
乮俀乯丂乽懴悈惈乿偺乽曐岇枌乿偲偟偰偼堦椺偲偟偰乽俴俿俙俹乿乮Li1+x+yTi2-xAlxP3-ySiO12)(x=
0.3,y=
0.2))偑巊梡偝傟傞丅
乮俁乯丂偟偐偟乽俴俿俙俹乿偼乽儕僠僂儉嬥懏乿偲愙怗偡傞偲斀墳偡傞偺偱娫偵乽娚徴枌乿傪憓擖偡傞丅
乮係乯丂乽娚徴枌乿偲偟偰偼堦椺偲偟偰乽俹俤俷乿偑巊梡偝傟傞丅
[俁丏俀丏俀]丂丂悈惈揹夝塼丂
乮侾乯丂乽曐岇枌乿偺乽俴俿俙俹乿偼乽悈惈揹夝塼乿偺乽倫俫乿偑乽俈乿傛傝戝偒偄偲乽俴倝俁俹俷係乿傪惗惉偡傞丅
乮俀乯丂偩偐傜乽悈惈揹夝塼乿偺乽倫俫乿傪庛巁惈偵堐帩偡傞丅丂丂
乮俁乯丂乽悈惈揹夝塼乿偵乽恷巁乿丄乽巟帩墫乿偵乽恷巁儕僠僂儉乿側偳偺傛偆偵乽庛巁梟攠乿偵乽庛巁儕僠僂儉墫乿傪梟夝偟偰
丂丂丂
乽悈宯揹夝塼乿偺乽倫俫乿傪乽庛巁惈乿偺堦掕偵埨掕偝偣傞丅
乮係乯丂偦偟偰偦偺乽悈惈揹夝塼乿偺拞偱乽悈巁壔儕僠僂儉乿傪乽朞榓忬懺乿偵偟偰偍偗偽
丂丂丂丂乽曻揹夁掱乿偱偼乽悈巁壔儕僠僂儉乿偑愅弌偡傞偩偗偱乽悈惈揹夝幙乿偼
丂丂丂丂乽庛傾儖僇儕乿偵堐帩偝傟傞丅
- 乮俆乯丂 偙偙偱傕乽傾僯僆儞揱摫枌乿偱乽惓嬌乿傪旐偆丅
[俁丏俀丏俁]丂丂丂惓嬌峔憿
乮侾乯丂丂怗攠偺慖戰丅
[俁丏俁]丂丂丂乽俙乕俼俴俙俛乿偺尋媶惉壥偺椺丂丂丂
[俁丏俁丏侾]丂丂丂嶰廳戝妛偺尋媶寢壥丂丂
Membranes 2013, 3(4),
298-310; doi:10.3390/membranes3040298
Article
Interface Properties
between Lithium Metal and a Composite Polymer Electrolyte
of
PEO18Li(CF3SO2)2N-Tetraethylene Glycol Dimethyl Ether
Hui Wang
(1), Masaki Matsui(1), Yasuo Takeda (1), Osamu Yamamoto
(1),* , Dongmin Im (2),
Dongjoon Lee (2) and Nobuyuki Imanishi
(1)
[俁丏俁丏侾丏侾]丂丂僔僗僥儉峔惉
乮侾乯丂乽俴俿俙俹乿偱乽悈惈揹夝塼乿偺懴悈枌傪峔惉偟偰偄傞丅
乮俀乯丂乽俴俿俙俹枌乿偲乽晧嬌乿偺乽儕僠僂儉乿偺娫偺乽娚徴枌乿偵乽PEO18LiTFSI-2TEGDME乿傪梡偄偰偄傞丅
乮俁乯丂乽揹夝塼乿偼乽墫壔儕僠僂儉乿偺乽朞榓悈梟塼乿丅
乮係乯丂乽惓嬌乿偺乽怗攠乿偼乽敀嬥乿丅
[俁丏俁丏侾丏俀]丂丂丂丂尋媶寢壥
乮侾乯丂恾侾偺傛偆側僨乕僞偑摼傜傟偰偄傞丅
乮俀乯丂乽侾侽侽僒僀僋儖乿傑偱埨掕偱偁傞丅
乮俁乯丂揹棳枾搙偼乽侾倣俙/們倣俀乿偱偁傞丅
丂丂丂丂丂丂丂恾侾 丂丂Discharge and charge profiles for
Li/PEO18LiTFSI-2TEGDME/LTAP/saturated LiCl
丂丂丂丂丂丂丂丂丂丂丂丂aqueous
solution/Pt, air cell at 1.0 mA cm−2 and 60 亱C. 丂 [52].
丂丂丂丂丂丂丂乮俿俫俬俽丂丂俥俬俧倀俼俤丂俬俽丂俻倀俷俿俤俢丂俥俼俷俵丂丂俥俬俧丂俇丂俷俥丂俿俫俤丂俹俙俹俤俼丂俽俙俬俢丂俙俛俷倁俤乯
[俁丏俁丏侾丏俁]丂丂丂僨乕僞偺昡壙
乮侾乯丂丂Fig.
6 shows the lithium deposition and stripping potential change at 乽1.0 mA cm−2乿
and at 60 亱C
丂丂丂丂
for Li/PEO18LiTFSI-2TEGDME/LTAP/saturated LiCl aqueous
solution/Pt, air cell,
丂丂丂丂where a platinum black reference electrode
was used.
乮俀乯丂丂The composite polymer electrolyte of PEO18LiTFSI and
TEGDME showed a low and stable interface
丂丂丂丂丂resistance between lithium
and the polymer electrolyte of 85 兌 cm2 at 60 亱C.
乮俁乯丂丂The lithium
electrode is quite stable in the aqueous electrolyte.
乮係乯丂丂The
solubility of LiOH is 5.3 M L−1 and saturation of LiOH in the electrolyte is
reached
丂丂丂丂丂at about 5% discharge depth.
-
[係]丂丂曽幃乮俁乯丂乽惓嬌乿懁傪乽悈惈揹夝塼乿丄乽晧嬌乿懁傪乽旕悈惈揹夝塼乿偵偡傞乽俼俴俙俛乿
[係丏侾]丂丂奣擮
乮侾乯丂俀侽侽俋擭偵擔杮偺乽俙俬俽俿乿偐傜乽晧嬌乿懁偺乽揹夝塼乿偵乽桳婡塼懱乿傪梡偄丄乽惓嬌乿懁偺乽揹夝塼乿偵
丂丂丂乽悈惈揹夝塼乿傪梡偄偰拞娫偵乽儕僠僂儉丒僀僆儞乿偩偗傪摟夁偝偣傞
丂丂丂乽屌懱揹夝幙乿傪擖傟偰椉幰傪妘偰傞乽俼俴俙俛乿偺僔僗僥儉乮埲壓乽俫乕俼俴俙俛乿偲尵偆乯偑敪昞偝傟偨丅
乮俀乯丂乽曻揹夁掱乿偱偼乽惓嬌乿偱偼乽巁慺乿偼乽揹巕乿傪乽摫懱乿偐傜庴偗庢偭偰乽悈乿偲斀墳偟偰
丂丂丂丂丂丂丂丂俀俫俀俷亄俷俀亄係倕乕丂丂丂佀丂丂係俷俫亅
丂丂丂丂偺傛偆側乽悈巁壔僀僆儞乿傪惗惉偡傞丅
乮俁乯丂偦偟偰乽悈惈揹夝塼乿偺拞偱乽晧嬌乿偐傜棃偨乽儕僠僂儉丒僀僆儞乿偲崌懱偟偰
丂丂丂丂乽曻揹惗惉暔乿偺乽悈巁壔儕僠僂儉乿偑惗惉偝傟傞丅
乮係乯丂乽悈巁壔儕僠僂儉乿偼乽悈惈揹夝塼乿偵梟夝偟偰偄傞丅
乮俆乯丂乽曻揹夁掱乿偺恑峴偵敽偭偰乽悈巁壔儕僠僂儉乿偺検偑憹戝偡傟偽
丂丂丂丂朞榓梟塼忬懺偵側偭偰傗偑偰乽悈巁壔儕僠僂儉乿偑乽悈宯揹夝塼乿偵愅弌偡傞丅
乮俇乯丂愅弌偟偨乽悈巁壔儕僠僂儉乿偑乽惓嬌乿偵晅拝偟偰偼晄搒崌偱偁傞丅
乮俈乯丂乽惓嬌乿傪嬻婥拞偺乽扽巁僈僗乿傪幷抐偟偰乽悈惈揹夝塼乿偲乽悈巁壔僀僆儞乿偩偗傪
丂丂丂
捠偡乽傾僯僆儞揱摫懱乿偱旐偆偟偐側偄丅
丂丂
乮俉乯丂曻揹偵廬偭偰乽悈巁壔儕僠僂儉乿偑偳傫偳傫愅弌偡傞丅丂
乮俋乯丂乽廩揹夁掱乿偱偼乽悈惈揹夝幙乿偵梟夝偟偰偄傞乽悈巁壔儕僠僂儉乿傪
丂丂丂
暘夝偟偰乽揹巕乿傪乽惓嬌懁乿偺乽摫懱乿偵曻弌偟偰
乽儕僠僂儉丒僀僆儞乿偲乽巁慺乿傪曻弌偡傞丅
乮侾侽乯丂乽儕僠僂儉丒僀僆儞乿偼乽屌懱揹夝幙乿傪摟夁偟偰乽晧嬌乿偺乽儕僠僂儉嬥懏乿偵棃偰
丂丂丂丂乽摫懱乿偐傜乽揹巕乿傪庴偗庢偭偰乽儕僠僂儉嬥懏乿偲側偭偰昞柺偵愅弌偡傞丅丂
[係丏俀]丂丂媄弍揑壽戣
[係丏俀丏侾]丂丂屌懱揹夝幙
乮侾乯丂乽惓嬌乿懁偺乽悈惈揹夝塼乿偲乽晧嬌乿懁偺乽旕悈惈揹夝塼乿傪巇愗傞
丂丂丂
埨掕偱乽儕僠僂儉僀僆儞揹摫搙乿偺崅偄乽屌懱揹夝幙乿傪妋棫偡傞丅
[係丏俁]丂丂俫亅俼俴俙俛偺尋媶惉壥偺椺
乮侾乯丂乽揹棳枾搙乿偑乽俆侽侽倣俙/g乿偺尋媶椺偼摼傜傟偰偄側偄丅
[俆]丂丂丂曽幃乮係乯丂乽揹夝幙乿傪乽屌懱揹夝幙乿偵偟偨乽俼俴俙俛乿

丂丂丂MERCI
TRES BIEN POUR VOTRE ATTENTION CONTRE LIRE MA INTERNET SITE.
JE SUIS UNE DAME SENESCENTE
QUI EST TRES BELLE ENCORE.
丂丂丂丂
丂丂丂丂丂丂丂丂丂
丂丂丂丂丂丂丂 惔彮擺尵偺傛偆側榁彈偺悇慐偺揹巕彂愋
丂丂丂丂 丂丂丂俙俵俙倅俷俶丂偺丂" 俲俬俶俢俴俤 "
偺揹巕彂愋偱偡丅丂
丂丂丂丂
丂丂丂丂丂丂丂丂丂丂丂丂丂挿曇悇棟彫愢丂丂丂惵摵偺錕錘丂
丂丂丂 枾幒僩儕僢僋偲傾儕僶僀丒僩儕僢僋傪嬱巊偟偰帺屓偺塰岝偺偨傔偵
丂丂 廫嶰擭傪妘偰偨擇偮偺楢懕嶦恖傪斊偟偨擇帪娫僒僗儁儞僗丒僪儔儅
丂丂
偺旤杄偺彈桪偲偺抦宐斾傋偵丄恄撧愳導寈偺嬨棖嶈楃嬨榊晹挿孻帠偲
丂丂 巹棫扵掋偺壞栘嫗夘偺僐儞價偼彑偮偙偲偑弌棃傞偐丠
丂丂
晳戜偼廫嶰擭慜偺徍榓俆俆擭偺嫗搒偐傜巒傑傝丄暯惉俆擭尰嵼偺
丂丂 恄屗偺榋峛嶳偲墶昹偵傑偱峀偑傝丄僲儞僗僩僢僾傾僋僔儑儞偱揥奐偟偰備偔丅
丂丂
偙傟傑偱怓乆側傾儕僶僀僩儕僢僋偑偁傝傑偡偑丄
丂丂
偙傫側婏敳偱婏憐揤奜側傾儕僶僀僩儕僢僋偼暦偄偨偙偲偑偁傝傑偣傫丅
丂丂儔僗僩僔乕儞偺垼愗嬌傑傞旤偟偝偵偼尵梩偑偁傝傑偣傫丅
丂丂丂丂丂丂丂丂丂丂丂
挿曇悇棟彫愢丂丂丂惞曣偺擑丂
丂丂丂丂丂丂丂丂丂
丂丂丂屆搒撧椙偺抧偱丄徍榓巐廫嬨擭偺壞媥傒偺廔傢傝偵柤栧偺巹棫彈巕崅峑偺
丂丂丂僷儖僥儈僗僞儔儈傾彈妛堾偺惗搆偑楒恖偲堦弿偵偄偨偲偒偵楒恖偲偲傕偵
丂丂丂壗幰偐偵嶦奞偝傟偨丅
丂丂丂偦偟偰帠審偐傜擇廫擇擭宱偭偨暯惉敧擭偵側偭偰丄擔杮偺奺抧傪晳戜偵偟偰
丂丂丂暅廞寑偺枊偑忋偑偭偨丅
丂丂丂嶦奞偝傟偨偺偼丄傒側徍榓屲廫擭偵僷儖僥儈僗僞儔儈傾彈妛堾傪懖嬈偟偨
丂丂丂僄儕乕僩彈惈偽偐傝偱偁偭偨丅
丂丂丂斊恖偼堦懱扤側偺偐丠斊恖偼偳偺傛偆側摦婡偱嶦奞偟偰偄傞偺偐丠
丂丂丂壗屘擇廫擇擭傪宱偰暅廞偑巒傑偭偨偺偐丠寈嶡挕峀堟憑嵏姱寧塭壚懢榊偼
丂丂丂師戞偵斊恖傪捛偄媗傔偰偄偔偑丄嵟屻偺偳傫偱傫曉偟傪寎偊傞丅
丂丂丂丂丂丂丂丂丂丂丂丂
挿曇悇棟彫愢丂丂丂旝擬偺揤巊丂
丂丂丂丂丂丂丂丂丂
丂丂丂丂徍榓榋廫擭偵戝嶃偱尰嬥桝憲幵偑廝寕偝傟傞帠審偑婲偙偭偨丅
丂丂丂丂帠審偼柪媨偵擖偭偨丅偦偺帠審偵姫偒崬傑傟偰巓偲晝傪嶦偝傟偨旤杄偺
丂丂丂丂彈幮挿偼暯惉廫幍擭偵側偭偰偦偺帠審偺斊恖払偵暅廞傪巒傔偨丅
丂丂丂丂偦偟偰斊恖払偼枾幒偺拞偱師乆偲婏夦側巰偵曽傪偟偰偄偭偨丅
丂丂丂丂寈帇挕憑嵏堦壽偺戭娫寈晹偼丄徍榓屲廫敧擭偵嫗搒偱婲偙偭偰偄偨
丂丂丂丂柪媨擖傝偺枾幒嶦恖帠審傪抦傞偵媦傫偱丄偦偺枾幒嶦恖帠審偲
丂丂丂丂崱夞偺楢懕嶦恖帠審偲偺娭楢惈偵婥晅偒丄斊恖偲偺憇愨側抦宐斾傋偵
丂丂丂丂擖偭偰偄偭偨丅
丂丂丂丂旝擬偺揤巊偲偼堦懱壗幰側偺偐丠偦傟偼帠審偲偳偺傛偆偵棈傫偱偔傞偺偐丠
丂丂丂丂搑曽傕側偄枾幒僩儕僢僋偑偙偺彫愢偱弶傔偰摫擖偝傟傞丅
丂丂丂丂廫復偐傜側傞挿曇偱偁傞丅
丂丂丂
丂丂丂丂丂丂丂丂丂丂挿曇悇棟彫愢丂懮媑擈偺嶰柺嬀丂
丂丂丂丂丂丂丂丂丂
丂丂丂丂僄儕乕僩堛巘偑師乆偵僐乕僥傿僓儞傪憰偭偨彈偵忣岎偺屻偱嶦奞偝傟傞
丂丂丂丂帠審偑楢懕偟偰婲偙傞丅堦懱斵傜偼夁嫀偵偳傫側偙偲傪偟偨偺偐丠
丂丂丂丂偨偖偄婬側旤杄偺昦堾挿偑悢婏側塣柦偺拞偱懱尡偟偨憐憸傪愨偡傞偙偲偑
丂丂丂丂偙偺暔岅偺崻掙偵晄壜夝側撲傪鑊傔偰偄傞丅
丂丂丂丂峀堟憑嵏姱嶳塭寈帇偲巹棫扵掋壞栘嫗夘偼旤杄偺斊恖傪偳偙傑偱
丂丂丂丂捛偄媗傔傞偙偲偑弌棃傞偺偐丠暔岅傝傪嵟屻傑偱撉傫偩偲偒撉幰偼晄壜夝側
丂丂丂丂偳傫偱傫曉偟偵憐憸傪弰傜偣傞偱偁傠偆丅
丂丂
丂丂丂丂丂
丂丂
丂
丂丂丂









